脑卒中(俗称“中风”)是全球范围内导致死亡和残疾的主要原因之一,其中急性缺血性脑卒中最为常见。目前,临床主要通过溶栓、取栓等再灌注疗法恢复血流,但这些方法有严格的时间限制,且伴有出血风险。
近日,首都医科大学宣武医院、国家神经疾病医学中心的团队在《Cell Communication and Signaling》期刊上发表综述,系统探讨了诱导多能干细胞来源的外泌体(如 GD-iExo-003)干预急性缺血性脑卒中的潜力,并已进入临床评估阶段。这标志着外泌体应用正从实验室走向临床实践。

那么,外泌体究竟是什么?它又如何为脑卒中患者带来新的希望呢?
临床困境:血管通了,大脑为什么还在受损?“时间就是大脑”是卒中救治的核心原则。然而,临床上常常遇到“血管再通后神经功能仍无法恢复”的情况。这是因为缺血以及血流恢复后的“再灌注”过程,会引发一系列连锁损伤:炎症反应加剧、自由基大量产生、血脑屏障受损,从而导致脑水肿加重和神经元死亡。
这一阶段的脑损伤,目前缺乏有效的干预手段,被称为神经保护的“治疗黑箱”。于是,研究人员开始思考:有没有一种方法,能在血管再通之后,帮助稳定脑内环境、减轻继发性损伤?
干细胞外泌体正是基于这一思路涌现的新方向。外泌体是细胞自然分泌的微小囊泡,直径约 30–150 纳米,可携带蛋白质、RNA、脂质等生物活性物质。它们能穿过血脑屏障,像“精准修复包裹”一样,将有益成分递送至损伤部位,从而抑制炎症、保护神经元、促进血管新生与神经修复。
外泌体最初在免疫、肿瘤等领域被看作细胞间的“通信工具”。在脑卒中研究中,动物实验显示:向大脑中动脉阻塞的大鼠注射来源于间充质干细胞或诱导多能干细胞的外泌体后,脑梗死面积平均缩小约 35%–50%,炎症因子水平下降,神经功能评分也在数周内逐步改善。

这些结果提示,外泌体并非针对单一靶点,而是通过多途径、系统性调节,在卒中后的复杂病理环境中发挥保护与修复作用。
外泌体修复大脑的三大作用机制外泌体为干预卒中后“治疗黑箱”提供了新可能。其潜在机制主要包括以下三方面:
抗炎调控,阻断恶性循环外泌体携带特定的 microRNA(如 miR-124 等),可调节免疫细胞功能,抑制过度炎症反应,从而减轻继发性脑损伤。
保护血脑屏障,减轻脑水肿外泌体有助于提升血脑屏障紧密连接蛋白(如 ZO-1)的表达,增强屏障完整性,降低血管渗漏和脑水肿风险,为大脑恢复提供更稳定的内环境。
直接保护神经元,挽救濒危细胞外泌体可递送营养因子与抗凋亡信号,保护缺血半暗带内尚未完全死亡的神经元,为提高患者后期神经功能恢复奠定基础。
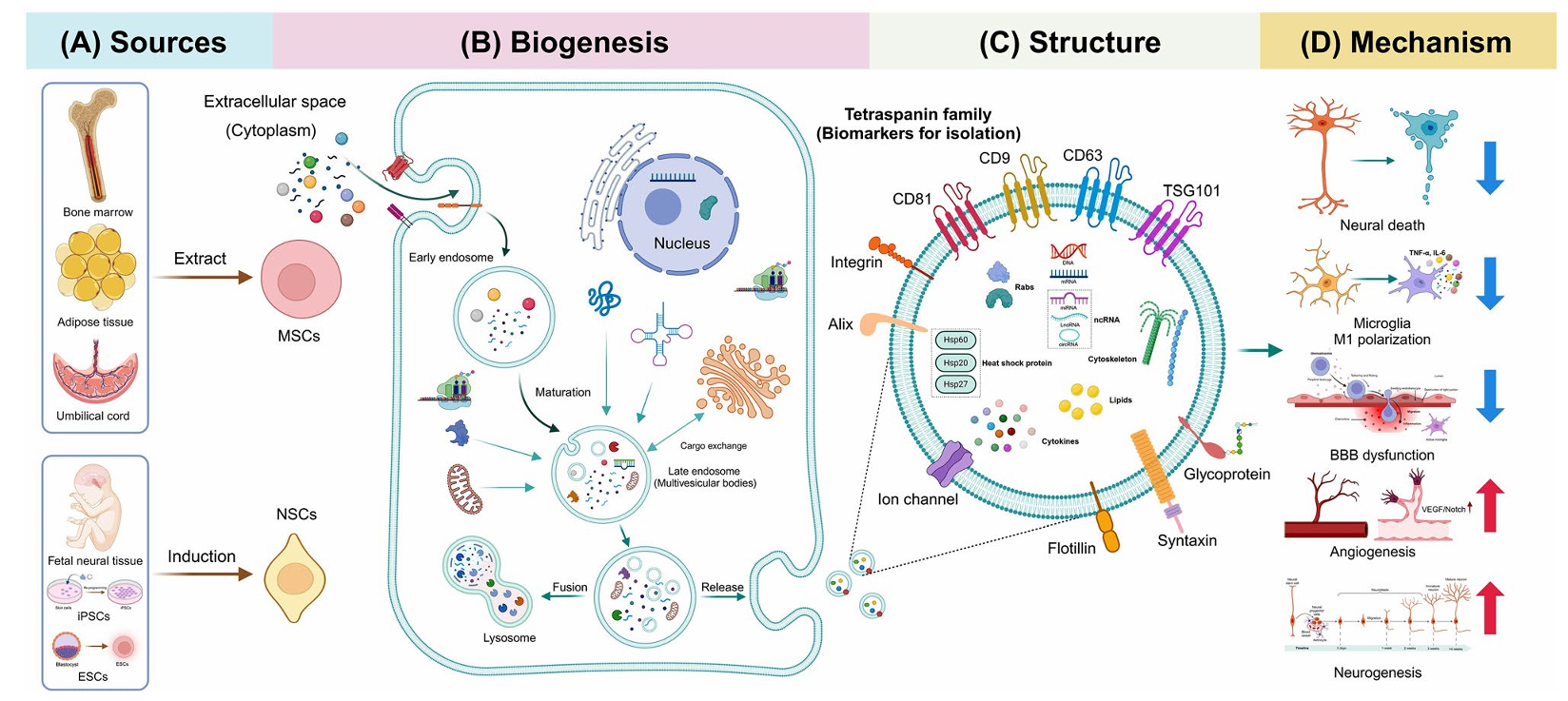
外泌体并不能替代现有的治疗手段,也无法让已坏死的脑组织再生。它的意义在于,为卒中后脑保护提供了一种新的辅助干预思路,尤其是在再灌注后的关键修复期。
相关的临床研究仍在进行中,但外泌体干预正经历从基础研究到临床应用的严格检验。如果未来能通过这种策略,帮助卒中患者多保留一分神经功能、多挽回一点生活质量,那么这一切探索都将具有重要的意义