当"不吃"成为治疗策略
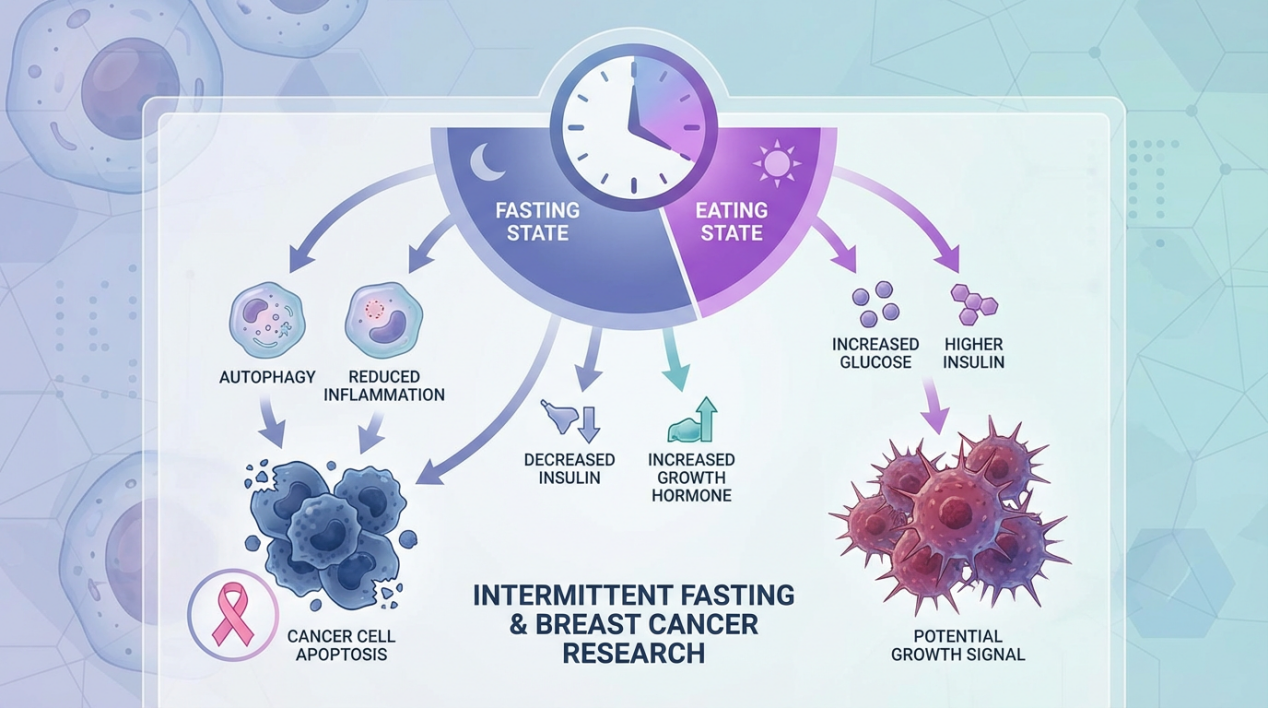
大多数乳腺癌患者在接受他莫昔芬等内分泌治疗时,都会被告知要"好好吃饭,保持营养"。但《自然》杂志12月10日发表的一项研究[1]却提出了截然相反的建议:定期禁食可能比"好好吃饭"更能帮助这些患者对抗癌症。
荷兰癌症研究所Nuno Padrão领衔的研究团队,通过多种乳腺癌动物模型和多组学追踪技术,发现间歇性禁食能显著增强激素受体阳性(ER-α+)乳腺癌对他莫昔芬的治疗反应,并延缓耐药性的产生。更重要的是,他们揭示了这一现象背后的关键机制——糖皮质激素受体(GR)的激活。这项研究不仅为约70%的乳腺癌患者(ER-α阳性亚型)带来了新的治疗选择,也重新定义了代谢干预在癌症治疗中的角色。从偶然观察到机制突破
间歇性禁食抗癌的故事并非从零开始。早在数年前,临床医生就注意到一个有趣的现象:一些自发采用间歇性禁食的乳腺癌患者,似乎对内分泌治疗有更好的反应。但这种观察一直停留在"现象"层面——没人能说清楚为什么。
Padrão团队花了数年时间追踪这个谜团。他们首先在小鼠模型中验证了禁食的疗效:接受周期性禁食的小鼠,在他莫昔芬治疗下肿瘤缩小速度明显加快,耐药性出现的时间显著延迟。但真正的突破来自多组学分析——当研究人员比较禁食与非禁食小鼠的肿瘤细胞时,他们发现了一系列广泛的表观遗传重编程。
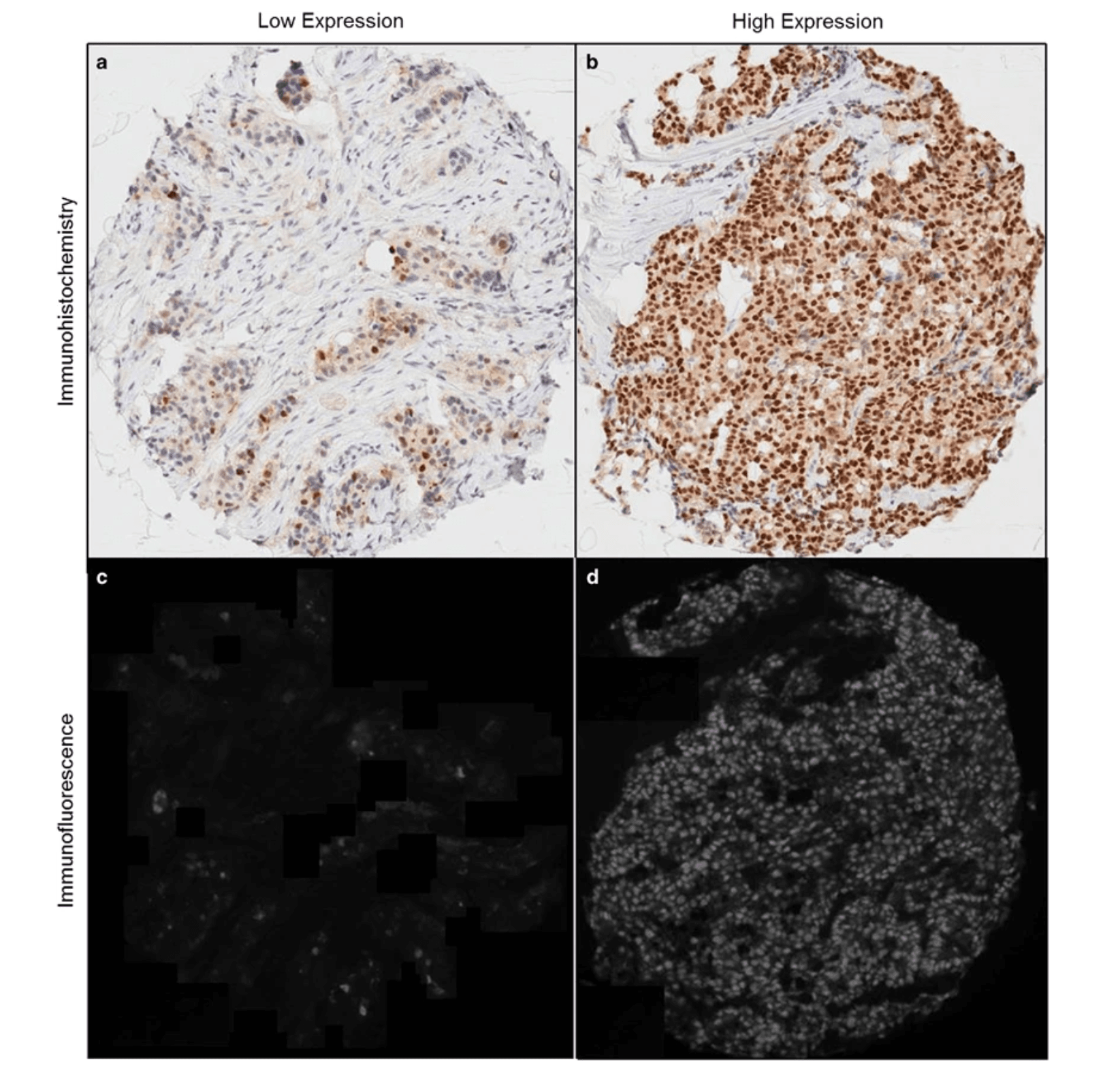
图片来源:Nature杂志,显示乳腺癌组织中ER-α受体的表达分布
这些变化最终指向一个关键靶点:糖皮质激素受体(GR)。禁食会激活GR相关的信号通路,这些通路能抑制细胞分裂,防止耐药性发展——特别是在luminal A亚型(ER-α阳性乳腺癌的主要亚型)中效果最为显著。
糖皮质激素:被低估的抗癌武器
糖皮质激素受体的激活,本质上是身体应对"饥饿压力"的自然反应。当我们禁食时,体内的皮质醇等糖皮质激素水平上升,这些激素与GR结合后,会启动一系列保护性程序——在正常细胞中,它们帮助维持能量平衡;但在癌细胞中,它们却意外地成了"刹车器"。
研究团队发现了一个关键细节:禁食诱导的GR激活,会降低血液中IGF-1(胰岛素样生长因子-1)、胰岛素和瘦素的水平。这三种代谢激素在乳腺癌中扮演"生长加速器"的角色——它们激活PI3K-AKT-mTOR信号通路,促进细胞增殖,削弱内分泌治疗效果,并推动耐药性产生。禁食通过GR通路"关闭"了这些加速器。
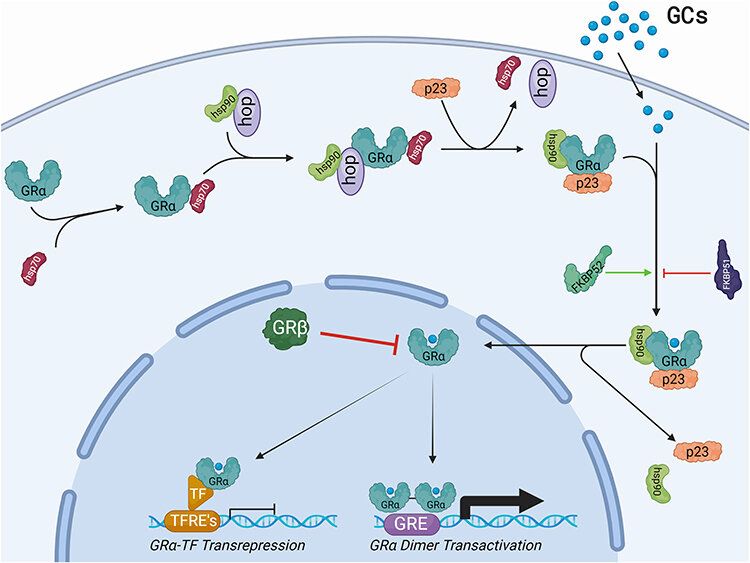
图片来源:ResearchGate,展示GR从细胞质到细胞核的信号传导过程
但这里有个微妙的平衡:GR激活对不同亚型的乳腺癌效果截然不同。在ER-α阳性的luminal A型乳腺癌中,GR激活是强效的癌症抑制机制;但在三阴性乳腺癌(缺乏ER、PR和HER2受体)中,GR激活反而可能促进肿瘤生长[2]。这解释了为什么早期糖皮质激素治疗乳腺癌的临床试验结果平平——那些研究没有根据受体状态对患者分类。
从禁食到药物:更实用的选择
尽管禁食有效,但让癌症患者长期坚持周期性禁食并不现实。好消息是,研究团队发现,直接使用GR激动剂(如地塞米松)可以完全模拟禁食的抗肿瘤效果,而无需真的挨饿。
在动物实验中,地塞米松联合他莫昔芬的效果与"禁食+他莫昔芬"如出一辙:肿瘤缩小更快,耐药性出现延迟,代谢指标(IGF-1、胰岛素等)同样下降。这为临床应用开辟了更便捷的路径。
目前FDA已批准多种糖皮质激素类药物,如泼尼松龙、甲泼尼龙、氢化可的松等,它们成本低廉,特性明确。但传统糖皮质激素的问题在于副作用——长期使用会抑制免疫系统,引发代谢紊乱,甚至增加骨质疏松和糖尿病风险,这在癌症治疗中是必须警惕的。
幸运的是,新一代选择性糖皮质激素受体调节剂(sGRM)正在快速发展。这些分子能保留GR的有益信号通路,同时避开有害的副作用。例如,FDA已批准vamorolone用于治疗杜氏肌营养不良症——这种药物开发的初衷就是规避传统糖皮质激素的代谢和免疫抑制作用。另一个候选分子AZD9567在初步试验中显示出强效的抗炎活性,但骨质流失和血糖升高(高血糖)的风险极低,因此患糖尿病、心血管疾病和骨质疏松症的风险也较低[3]。
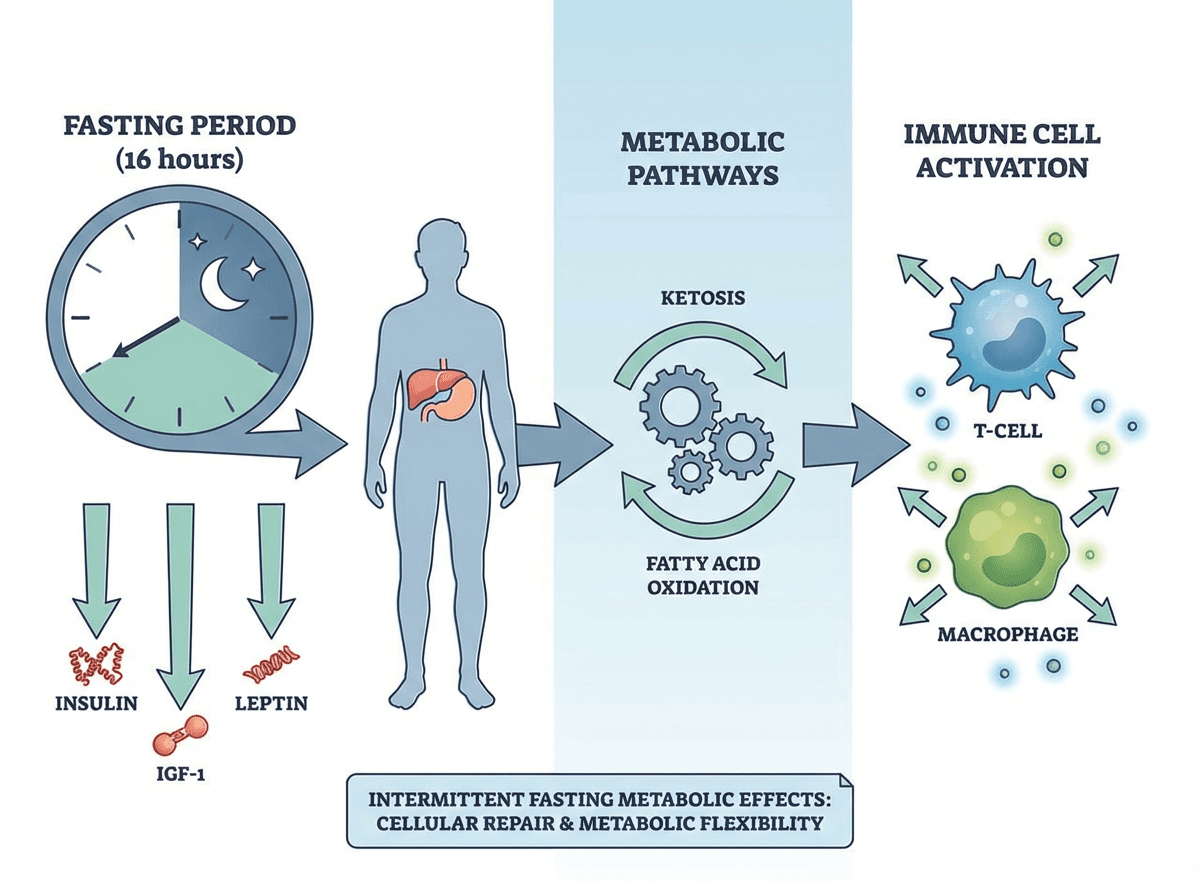
图片来源:Cell Press,显示禁食如何通过多条通路影响免疫和代谢
不止是药物:饮食干预的价值
即便有了药物选择,饮食干预仍有独特价值。Padrão团队证实,多种饮食模式都能激活GR并增强内分泌治疗效果:
周期性禁食:每周固定时间段(如连续24-48小时)完全禁食或极低热量摄入。研究显示这是效果最显著的方式,但对患者依从性要求最高。
模拟禁食饮食(FMD):每月进行5天的植物性低热量、低蛋白饮食方案,能触发类似禁食的代谢效应,同时提供少量食物。这种方式患者更容易坚持。
间歇性热量限制和生酮饮食:通过降低血液中胰岛素、瘦素和IGF-1水平,减少促生长信号。这些饮食模式也显示出一定的协同治疗潜力。
研究还发现,当给禁食的小鼠重新注射IGF-1、胰岛素或瘦素时,禁食的抗肿瘤效果会大幅减弱,皮质酮和孕激素水平也随之下降。这证实降低这些代谢激素水平在介导禁食抗癌效果中起因果作用。
GLP-1药物:意外的协同者?
另一个值得关注的方向是GLP-1受体激动剂——这类药物近年因减重效果而备受瞩目。研究提示,GLP-1药物(如tirzepatide,已获FDA批准用于减重和2型糖尿病)能驱动类似禁食的代谢重编程,包括降低胰岛素、瘦素和IGF-1,降低雌激素水平,诱导代谢应激信号等——这些机制与禁食增强内分泌治疗的路径高度重叠[4]。
在小鼠模型中,tirzepatide已被证实能逆转肥胖对乳腺癌、子宫内膜癌和结肠癌的促进作用。但目前尚无数据显示GLP-1药物是否能像禁食那样激活GR并减少内分泌治疗耐药。这需要通过动物模型和临床试验来验证。如果证实有效,GLP-1药物可能成为一种"上游"的药理学工具,在GR等代谢调节通路之前发挥作用,影响内分泌治疗反应。
重新审视代谢与癌症治疗
Padrão团队的工作揭示了一个更宏大的图景:身体的代谢状态(无论是通过禁食、饮食还是药物调节)能深刻重编程肿瘤细胞的表观遗传学和受体介导的信号传导。这提示代谢调控应该被更广泛地纳入癌症治疗策略。
对于乳腺癌领域,这项研究有几个直接启示:
首先,GR激活对ER-α阳性乳腺癌有益但对三阴性乳腺癌可能有害,这凸显了亚型特异性用药的重要性。过去那些未按受体状态分类患者的糖皮质激素临床试验,可能需要重新评估。
其次,研究为对抗获得性治疗耐药提供了新靶点。当前ER-α阳性乳腺癌患者在内分泌治疗后产生耐药是常见临床难题,GR激活通路的发现为逆转或延缓耐药提供了强有力的理论支撑。
最后,这些发现可能重塑ER-α阳性乳腺癌的临床治疗标准。将皮质类固醇、选择性GR调节剂或代谢干预与内分泌治疗联用,有望成为未来的常规方案。
从实验室到临床的距离
尽管前景诱人,但从动物实验到临床应用仍有诸多问题待解:最佳的GR激动剂剂量和给药方案是什么?如何平衡疗效与副作用?哪些患者亚群最可能受益?饮食干预与药物治疗如何权衡?
目前已有一些临床试验正在探索这些问题。例如,多项研究正在评估间歇性禁食联合内分泌治疗对转移性乳腺癌患者的可行性和疗效[5]。选择性GR调节剂如vamorolone虽已获批用于其他适应症,但在癌症领域的应用还需要更多证据。
无论如何,Padrão团队的工作已经打开了一扇新门——它证明了代谢调控不仅仅是"辅助手段",而可能是撬动癌症治疗格局的支点。对于那些正在与ER-α阳性乳腺癌搏斗的患者来说,这或许意味着,除了传统的药物和手术,她们的"餐盘"和"生物钟"也可能成为对抗疾病的武器。
参考文献:
[1] Padrão, N., et al. (2025). Fasting boosts breast cancer therapy efficacy via glucocorticoid activation.Nature. https://doi.org/10.1038/s41586-025-09869-0
[2] Chen, Z., et al. (2015). Glucocorticoid receptor promotes breast cancer metastasis.Nature Communications, 6, 8323.
[3] Ripa, L., et al. (2018). Discovery of AZD9567: an effective oral selective glucocorticoid receptor modulator.Journal of Medicinal Chemistry, 61(5), 1785-1799.
[4] Glenny, E. M., et al. (2025). GLP-1 receptor agonism alters cancer-associated metabolic and immune pathways.bioRxivpreprint.
[5] Combined intermittent fasting and exercise intervention in patients with metastatic, hormone receptor-positive breast cancer (FastER): a pilot feasibility trial.Breast Cancer Research and Treatment, August 2025.
作者:超能文献团队 | 超能文献(https://suppr.wilddata.cn/)