mRNA疗法逆转免疫衰老:让T细胞"返老还童"的突破性研究
75岁的流感疫苗接种率接近90%,但保护效力却只有40 - 60%——问题不在疫苗本身,而在于那些已经"疲惫不堪"的免疫细胞。12月17日发表在《自然》(Nature)杂志上的一项研究[1],让科学家们看到了改变这一困境的可能:利用mRNA技术,将衰老的免疫系统"重启"到年轻状态。
MIT和德国癌症研究中心(DKFZ)的研究团队发现,通过向肝脏递送编码三种关键免疫因子的mRNA,可以让老年小鼠重新产生年轻、活跃的T细胞,并显著提升它们对疫苗和癌症免疫治疗的应答能力。这项技术不试图逆转胸腺的萎缩,而是绕过这个"衰老瓶颈",把肝脏变成了一座临时的"免疫细胞工厂"。
当免疫系统按下"暂停键"
人体的免疫防线依赖于T细胞——这些白细胞能识别并清除病原体和癌变细胞。但随着年龄增长,位于心脏前方的小小器官胸腺逐渐萎缩,被脂肪组织取代。从成年早期开始,胸腺就开始这场不可逆的"退化之旅",到75岁时已几乎完全失去功能。
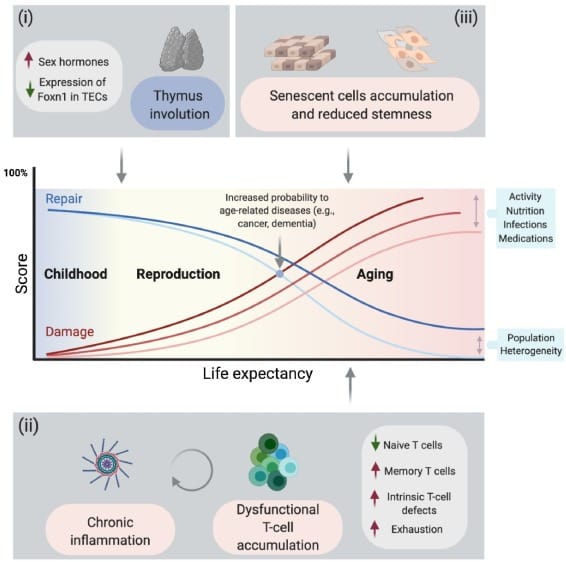
胸腺是T细胞的"训练营"——未成熟的T细胞在这里学习识别病原体,同时避免攻击自身组织。它还分泌IL - 7、FLT3 - L等关键生长因子,维持T细胞的生存和功能。研究第一作者、来自DKFZ的血液学家Mirco Friedrich解释:"胸腺萎缩后,新生T细胞的产量断崖式下降,已有的T细胞则逐渐积累功能障碍。"[2]
研究团队通过对小鼠生命全程的免疫系统进行单细胞测序和空间转录组分析,发现了一个惊人的模式:随着年龄增长,循环血液中的T细胞越来越少表现出"初始状态"(naive phenotype),取而代之的是大量"记忆型"和"耗竭型"细胞。这些"老兵"对新病原体反应迟钝,却对慢性炎症火上浇油。更糟的是,胸腺皮质上皮细胞与T细胞之间的Notch信号通路活性急剧下降,IL - 7和FLT3 - L的表达也随之减少[1]。
这种衰老模式在人类身上同样存在。每年冬季,老年人群的流感疫苗接种虽然覆盖率高,但真正获得保护的比例却远低于年轻人。癌症免疫治疗药物在老年患者中的疗效也普遍打折扣——2025年《自然·通讯》的一项研究显示,尽管老年癌症患者的免疫检查点抑制剂总体有效率尚可,但他们在治疗前的免疫表型就已明显异常,包括细胞因子反应减弱、耗竭标志物增加[3]。
肝脏:意外的"替代工厂"
过去几十年,科学家们尝试过用激素、细胞因子甚至"年轻血液"来逆转胸腺萎缩,但效果都差强人意,副作用还不小。Friedrich的团队决定换个思路:"既然胸腺已经衰败,我们为什么不在别处重建它的功能?"
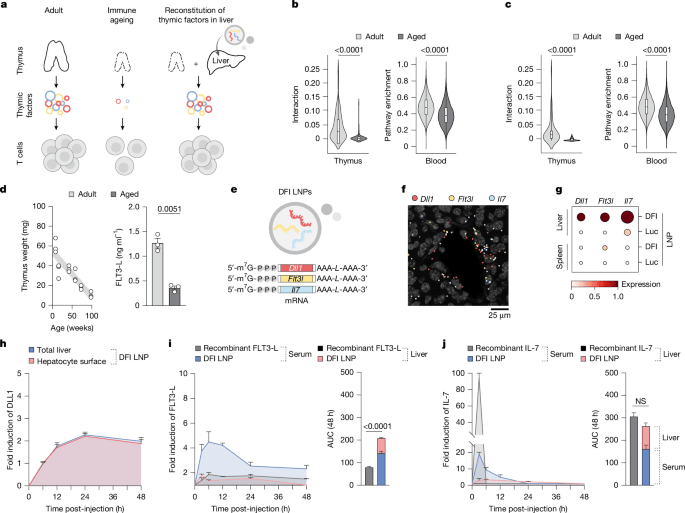
他们将目光投向了肝脏。这个代谢器官有三大优势:第一,全身血液每分钟都要流经肝脏,T细胞能与肝细胞充分接触;第二,肝脏的蛋白质合成能力即使在高龄也保持强劲;第三,近年来mRNA - 脂质纳米颗粒(LNP)技术的成熟,让向肝脏高效递送遗传物质成为可能——新冠mRNA疫苗已验证了这条路径的安全性。

研究团队筛选了三个关键靶点:DLL1(激活Notch信号通路的跨膜配体)、FLT3 - L(促进淋巴祖细胞增殖)和IL - 7(维持T细胞生存的核心细胞因子)。他们将编码这三个蛋白的mRNA用SM - 102 LNP包裹,每周注射两次,持续四周。
实验结果超出预期。通过RIBOmap技术(一种能追踪核糖体翻译的高分辨率成像方法),团队确认这三种mRNA在肝细胞中被高效翻译成蛋白质。DLL1牢牢镶嵌在肝细胞表面,持续表达长达48小时;FLT3 - L和IL - 7则被分泌到血液循环中,且浓度曲线比直接注射重组蛋白温和得多——后者往往引发细胞因子风暴,而mRNA疗法的峰值浓度只有前者的十分之一,却能维持更长时间的稳定水平[1]。
更巧妙的是,IL - 7会与肝脏细胞外基质中的硫酸肝素蛋白聚糖结合,形成一个"局部储存库"。当T细胞流经肝窦时,它们同时接触到肝细胞表面的DLL1和周围环境中的IL - 7、FLT3 - L,这种"三重信号"组合精准模拟了胸腺微环境。
重启免疫系统的"时钟"
四周的治疗后,老年小鼠的免疫系统发生了显著变化。最直观的指标是初始T细胞(CD44⁻CD62L⁺)数量的回升——在脾脏和外周血中,这类"年轻"T细胞的绝对数量增加了1.5 - 2倍,而记忆型T细胞并未显著增加,初始/记忆比例接近年轻小鼠水平[1]。

这些新生T细胞从哪里来?通过Rag2 - eGFP示踪系统(一种能标记新生成T细胞的转基因小鼠),研究人员发现,治疗后12小时内,胸腺中的双阴性(DN)早期祖细胞就开始表达Rag2基因——这是T细胞重组受体基因的标志。28天后,成熟的单阳性CD4⁺和CD8⁺ T细胞数量显著上升,外周血中的"T细胞受体切除环"(TREC,标志新近从胸腺输出的T细胞)水平也恢复到接近成年小鼠的程度[1]。
更深层的机制揭示,这三种因子协同作用于整个造血 - 免疫轴。在骨髓中,治疗显著扩增了共同淋巴祖细胞(CLP)——这是T细胞前体的"源头",随年龄急剧减少。关键的是,治疗后的CLP表面CCR9表达上调(一种归巢受体),使它们更容易迁移到胸腺[1]。
这并非简单的"催熟"效应。对照实验显示,单独使用IL - 7 mRNA会导致效应记忆T细胞过度增殖,但三因子组合却能平衡初始和记忆细胞的比例。深度V(D)J测序表明,治疗后的T细胞受体库多样性并未下降——这排除了"克隆扩增"的可能,证实新增的T细胞确实来自胸腺的重新生产[1]。
从疫苗到癌症治疗的"临床价值"
免疫系统的年轻化最终要体现在功能上。研究团队用卵清蛋白(OVA)疫苗测试了老年小鼠的免疫应答。未经治疗的老年小鼠在接种后,卵清蛋白特异性CD8⁺ T细胞数量稀少,召回刺激后的IL - 2和IFN - γ分泌量接近假接种组。但接受mRNA疗法的老年小鼠,疫苗诱导的特异性T细胞数量翻倍,细胞因子分泌水平与年轻对照组相当[1]。
更令人振奋的是癌症模型实验。团队给老年小鼠皮下接种B16黑色素瘤,随后联合使用PD - L1抗体(一种免疫检查点抑制剂)和mRNA疗法。单独使用PD - L1抗体时,老年小鼠的中位生存期仅为35天;加入mRNA疗法后,生存期延长至50天以上,部分小鼠的肿瘤完全消退[1]。机制分析显示,治疗组的肿瘤浸润淋巴细胞(TIL)数量增加,且CD8⁺ T细胞表现出更强的细胞毒性和持久性。
这些结果直击老年癌症治疗的痛点。尽管免疫检查点抑制剂在部分老年患者中仍有效,但整体应答率低于年轻患者。约翰斯·霍普金斯大学2025年的研究虽然发现老年人对免疫治疗的反应并非完全失效[3],但MIT团队的工作提供了一个可能的"增效方案"——通过预先"充值"免疫系统,让检查点抑制剂有更多"弹药"可用。
值得注意的是,这种疗法还改善了其他免疫细胞的功能。通过STARmap空间转录组技术,研究人员发现脾脏中的cDC1树突状细胞(负责抗原交叉呈递)数量增加,且CD40、CD83等共刺激分子表达上调。同时,与年龄相关的B细胞(ABC,一种促炎性B细胞亚群)比例下降,成熟滤泡B细胞比例上升[1]。这种"全方位"的免疫重塑,或许能解释为何疫苗和抗肿瘤效果提升如此显著。
安全性与未来:从小鼠到人类还有多远?
任何涉及免疫系统的疗法都面临一个核心风险:会不会触发自身免疫?毕竟,增加初始T细胞意味着更多未经"训练"的细胞进入外周。
研究团队对此进行了详尽的安全性评估。持续四周的治疗后,老年小鼠的体重、肝功能指标(转氨酶)、组织病理学均未出现异常。血清细胞因子谱分析显示,与重组蛋白组相比,mRNA组的促炎因子(GM - CSF、IL - 10、IL - 12、IL - 1β)水平显著更低[1]。最关键的是,研究人员检测了多种自身抗原特异性T细胞和自身抗体,均未发现明显升高——这表明新生成的T细胞仍然受到胸腺"中枢耐受"机制的约束。
不过,小鼠实验的局限性不容忽视。人类胸腺的退化时间跨度更长,且70岁以上老人的胸腺已近乎消失,是否还能被"激活"尚不明确。此外,人体的免疫复杂度远超小鼠——慢性病毒感染(如CMV)在老年人群中普遍存在,它们持续消耗T细胞库,这种"背景噪音"可能削弱疗法效果。
MIT张锋教授(本研究的通讯作者之一)在接受采访时表示:"我们的目标不是让人永葆青春,而是延长健康生活的时间跨度。如果能让免疫系统保持功能更久,许多与年龄相关的疾病——感染、癌症、慢性炎症——都可能被延迟或预防。"[2]
从技术角度看,mRNA - LNP平台的成熟度已经很高,新冠疫苗积累的海量安全性数据为其临床转化铺平了道路。但这项疗法需要多次给药,且需要精确控制三种因子的剂量比例,这对制剂稳定性和给药方案提出了挑战。Friedrich团队计划接下来在非人灵长类动物中测试,并探索是否可以用单次长效剂型取代多次注射。
另一个值得关注的方向是个体化调整。不同年龄段、不同健康状况的人,免疫衰老的模式可能不同。未来的疗法或许需要根据患者的T细胞库组成、胸腺剩余功能、骨髓造血状态来"定制"mRNA组合。
逆转衰老,还是接受衰老?
这项研究引发的思考超越了技术本身。人类对"逆转衰老"的追求从未停止,从古代炼金术到现代基因编辑,每一次突破都伴随着伦理争议。mRNA疗法的出现,再次让我们站在了选择的十字路口。
支持者认为,延缓免疫衰老与治疗心血管疾病、糖尿病本质上没有区别——都是对抗"不正常"的生理功能衰退。反对者则担忧,过度干预可能打破进化留下的平衡。比如,T细胞库的收缩是否也是一种保护机制,避免晚年自身免疫失控?
目前的数据尚不足以回答这些问题。但可以确定的是,这项技术的应用场景不会局限于"抗衰老"。对于接受骨髓移植的患者、HIV感染者、接受化疗后的癌症幸存者,免疫重建都是临床刚需。mRNA疗法或许能成为他们的"免疫系统重启键"。
正如西班牙国家研究委员会的免疫学家María Mittelbrunn评价的那样:"T细胞是衰老过程中变化最剧烈的细胞类型之一。如果我们能让它们恢复活力,其影响将是深远的。"[4]
从mRNA疫苗到mRNA抗癌药,再到如今的mRNA"青春之泉",这项技术正在改写医学的边界。或许在不久的将来,注射一针mRNA就能让你的免疫系统"重装上阵",不再是科幻,而是社区医院的常规治疗。
参考文献
[1] Friedrich, M., Pham, J., Tian, J., et al. (2025). Transient hepatic reconstitution of trophic factors enhances aged immunity.. https://www.nature.com/articles/s41586-025-09873-4
[2] MIT News. (2025, December 17). New study suggests a way to rejuvenate the immune system. https://news.mit.edu/2025/new-study-suggests-way-rejuvenate-immune-system-1217
[3] Johns Hopkins Medicine. (2025, April 21). Age-related divergence of circulating immune responses in patients receiving immune checkpoint inhibitor therapy.. https://www.nature.com/articles/s41467-025-58512-z
[4] Nature News. (2025, December 17). Restoring youth to old immune cells: mRNA therapy turns back the clock. https://www.nature.com/articles/d41586-025-04082-5
作者:超能文献团队|超能文献(https://suppr.wilddata.cn/)