
人表皮生长因子受体2(HER2)长期以来是筛选适合接受抗HER2靶向治疗患者的关键标志物,这一策略主要应用于乳腺癌,同时也适用于其它几种实体瘤。免疫组织化学(IHC)作为评估HER2表达水平的核心检测方法,在指导抗HER2靶向治疗中具有重要临床价值。然而,随着新型抗体药物偶联物(ADC,如T-DXd)在HER2低表达(HER2 low)和HER2超低表达(HER2 ultralow)乳腺癌患者中展现出显著的临床疗效,对HER2表达水平的精准判读提出了更高的要求。
IHC检测技术在判读HER2 low/ultralow时面临诸多挑战,主要源于HER2蛋白表达的宽动态范围与肿瘤内异质性、多种分析前变量(如抗体选择、检测流程差异等)以及IHC评分固有的主观性[1]。这些因素共同限制了对低水平HER2表达的准确识别,凸显出建立标准化操作规程、开发专门针对HER2低表达、可能具备更高灵敏度的新型检测方法的迫切需求。目前,已有若干旨在克服现有检测技术及评分体系局限性的新兴方法正处于研发阶段。
01.定量免疫荧光(QIF)
QIF检测原理与液体样本中浓度的测定类似,通过对泛细胞角蛋白(CK)界定的肿瘤细胞区域中的HER2表达水平进行定量分析,实现HER2表达水平的客观测量,克服了IHC检测的局限性。乳腺癌组织经过染色处理,以量化泛细胞角蛋白分子区室内的HER2信号。使用液相色谱-串联质谱(LC-MS/MS)技术对具有不同HER2表达水平的细胞系进行HER2定量,生成细胞系微阵列(CMA)标准品,该标准品与患者样本在同一托盘中使用自动染色仪进行检测。通过CMA标准品的数字图像进行细胞分割,将蛋白质组学测量结果转换为amol/细胞面积。利用标准曲线,将HER2信号转换为amol/平方毫米,适用于每个染色批次(图1)[2]。该方法提供了HER2表达的客观和定量评估,能够检测到低水平的HER2表达,有助于识别可能从HER2靶向ADC治疗中获益的患者。
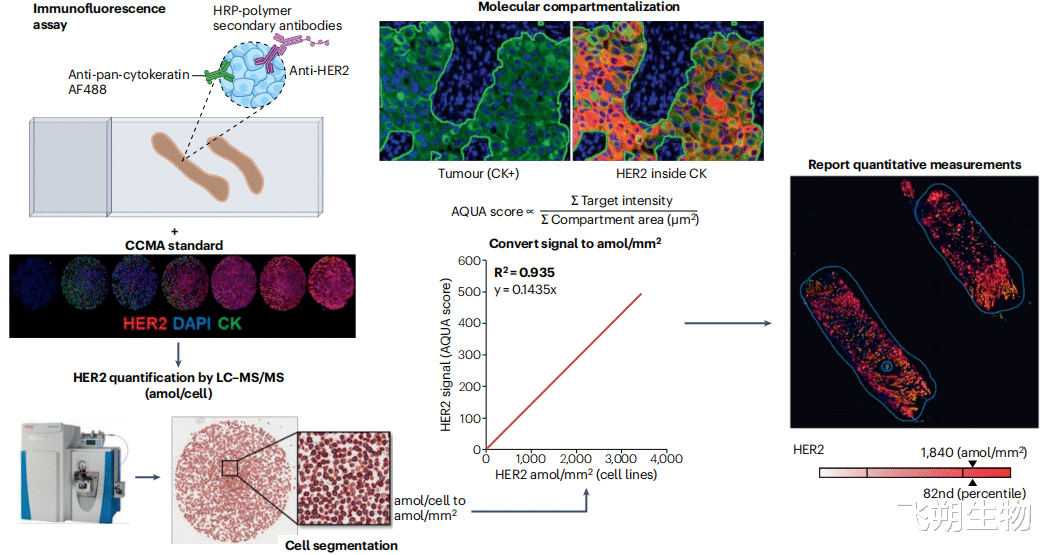
▲图1 定量免疫荧光(QIF)检测原理
一项研究纳入51例转移性乳腺癌患者(32例HER2+、19例HER2-)并验证了QIF检测HER2表达水平的性能。在所有患者中,HER2表达水平与TTNT(患者从入组(或开始当前治疗)到开始下一线治疗之间的时间)和OS(总生存期)均存在正相关。此外,当按四分位数划分时,TTNT与HER2表达水平之间也存在显著正相关,且随着HER2表达水平四分位数的增加,TTNT中位数呈上升趋势。在HER2+或HER2-转移性乳腺癌患者中也观察到一致的结果(图2)[3]。
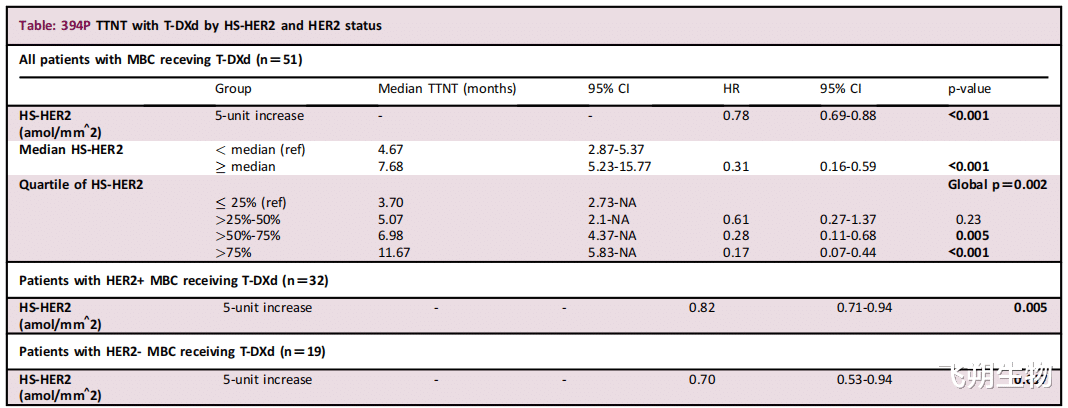
▲图2 TTNT伴T-DXd的HS-HER2和HER2状态
除乳腺癌外,QIF检测方法也在741例非小细胞肺癌患者中进行了验证,其中63%的患者可检测到HER2,17%的患者水平高于定量限(图3)[4]。这一发现表明,QIF检测方法有望识别出更多适合接受HER2靶向抗体药物偶联物治疗的患者,而不仅限于那些存在HER2扩增或突变的患者。
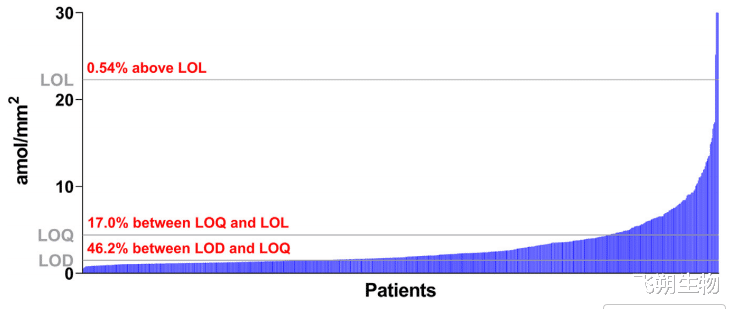
▲图3 741例非小细胞肺癌患者数据分布图
02.逆转录聚合酶链式反应(RT-PCR)
基于RT-PCR方法是评估和定量HER2 mRNA最直接的手段,有望协助评估低水平的HER2表达。
Oncotype DX检测的一项回顾性研究显示:平均复发风险评分(RS)在HER2 IHC 0组中为17.802,而在HER2 IHC 1+组为18.503;当RS>25时,HER2 IHC 0组约占12.4%(944例中的117例),HER2 IHC 1+组约占17.0%(1351例中的230例);RT-PCR检测的HER2评分在HER2 IHC 0组中为8.912,在HER2 IHC 1+组中为9.337(图4)[5]。这表明HER2 IHC评分为0和1+的患者之间的HER2 mRNA存在显著差异,HER2蛋白与mRNA水平在HER2低表达范围内存在相关性。然而,Oncotype DX检测尚未采用连续性蛋白质测量方法进行评估。
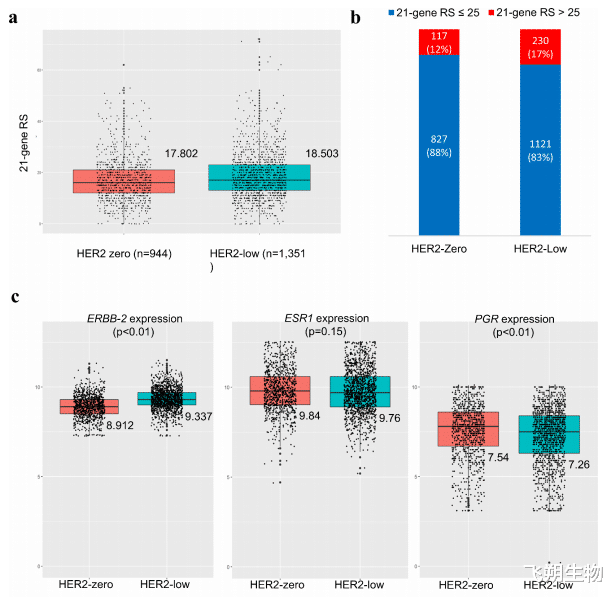
▲图4 Oncotype DX检测复发评分(RS)与HER2状态的比较
Xpert Breast Cancer STRAT4检测是通过ΔCt值来区分HER2表达阴阳性,即内参基因(CYFIP1)的Ct值减去目标基因(4个,包含HER2)的Ct值,从而来测定HER2 mRNA的水平,但与QIF检测相比缺乏空间异质性分析能力[6]。目前Xpert Breast Cancer STRAT4检测是一款CE- IVD产品,暂未获得FDA获批。
03.RNA原位杂交技术(RNAscope)
RNAscope是一种基于原位杂交(ISH)的mRNA检测方法,也已被用于研究HER2低表达乳腺癌中ERBB2的表达情况,可通过多探针杂交提供空间信息。研究表明,RNAscope可区分IHC 3+与2+(AUC=0.89),但对0与1+的鉴别效能不足(AUC=0.62)。此外,其评分依赖主观点数计数,缺乏标准化定量方法,且与QIF蛋白水平在低表达范围的相关性较差[7]。
04.HER2DX基因组检测
HER2DX检测是首个将临床数据与基因组数据整合的检测方法,能够同时捕获肿瘤特征、免疫特征及病理特征。HER2DX覆盖了27个基因检测,其中14个与免疫特征相关(即CD27、CD79A、HLA-C、IGJ、IGKC、IGL、IGLV3-25、IL2RG、CXCL8、LAX1、NTN3、PIM2、POU2AF1和TNFRSF17),4个与肿瘤细胞增殖特征相关(即EXO1、ASPM、NEK2和KIF23),5个与管腔分化特征相关(即BCL2、DNAJC12、AGR3、AFF3和ESR1),4个与HER2扩增特征相关(即ERBB2、GRB7、STARD3和TCAP)。该检测可以预测两种不同的临床终点:长期生存结局(即HER2DX风险评分)与达到病理完全缓解(pCR)的可能性(即HER2DX pCR评分),为优化治疗方案提供了新的指导依据(图5、图6)。HER2DX检测已参与了大量研究,现有研究证据表明,HER2DX风险评分可能有助于识别相当比例的早期HER2阳性乳腺癌患者,这些患者无需接受帕妥珠单抗、曲妥珠单抗或奈拉替尼等额外治疗。未来还需开展更多研究,以进一步验证HER2DX检测评分的临床价值[8]。

▲图5 HER2DX检测参与的临床研究
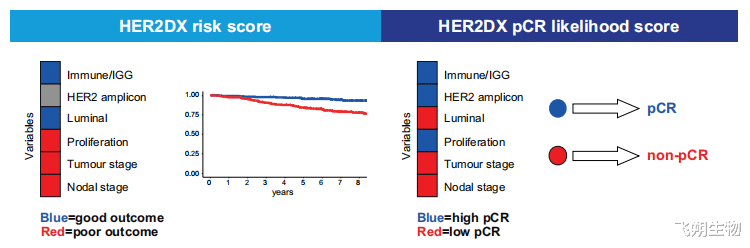
▲图6 HER2DX检测中包含的变量及其与各临床终点的关联性总结
05.小结
免疫组化现在仍然是几乎所有临床病理实验室的金标准方法。然而,随着病理数字化程度的提高以及对更准确信息的需求不断增长,新技术似乎有可能取代免疫组化的主观评估,成为新的伴随诊断检测。特别是对低水平HER2精确检测的要求,更准确的定量方法。相信随着技术的发展,将会有更多的精准检测技术应用于HER2表达检测,更精准地用于指导治疗。
参考文献
[1] Nature reviews Drug discovery,2023,22(2):101-126.
[2] Laboratory Investigation, 2022, 102(10): 1101-1108.
[3] Annals of Oncology,2024,35:S384-S385.
[4] Modern Pathology,2024,37(9):100556.
[5] Breast Cancer Research,2024,26(1):154.
[6] NPJ Breast Cancer,2019,5(1):28.
[7] Modern Pathology,2024,37(2):100408.
[8] EBioMedicine,2022,75.
声明:本文仅用于分享,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!