近期,国际权威期刊《Frontiers in Cell and Developmental Biology》刊载了一篇由中国长春中医药大学研究团队撰写的综述。该综述系统总结了间充质干细胞(MSCs)在改善骨骼肌功能以及干预重症肌无力(MG)方面的作用机制与研究进展。

间充质干细胞的基本特性
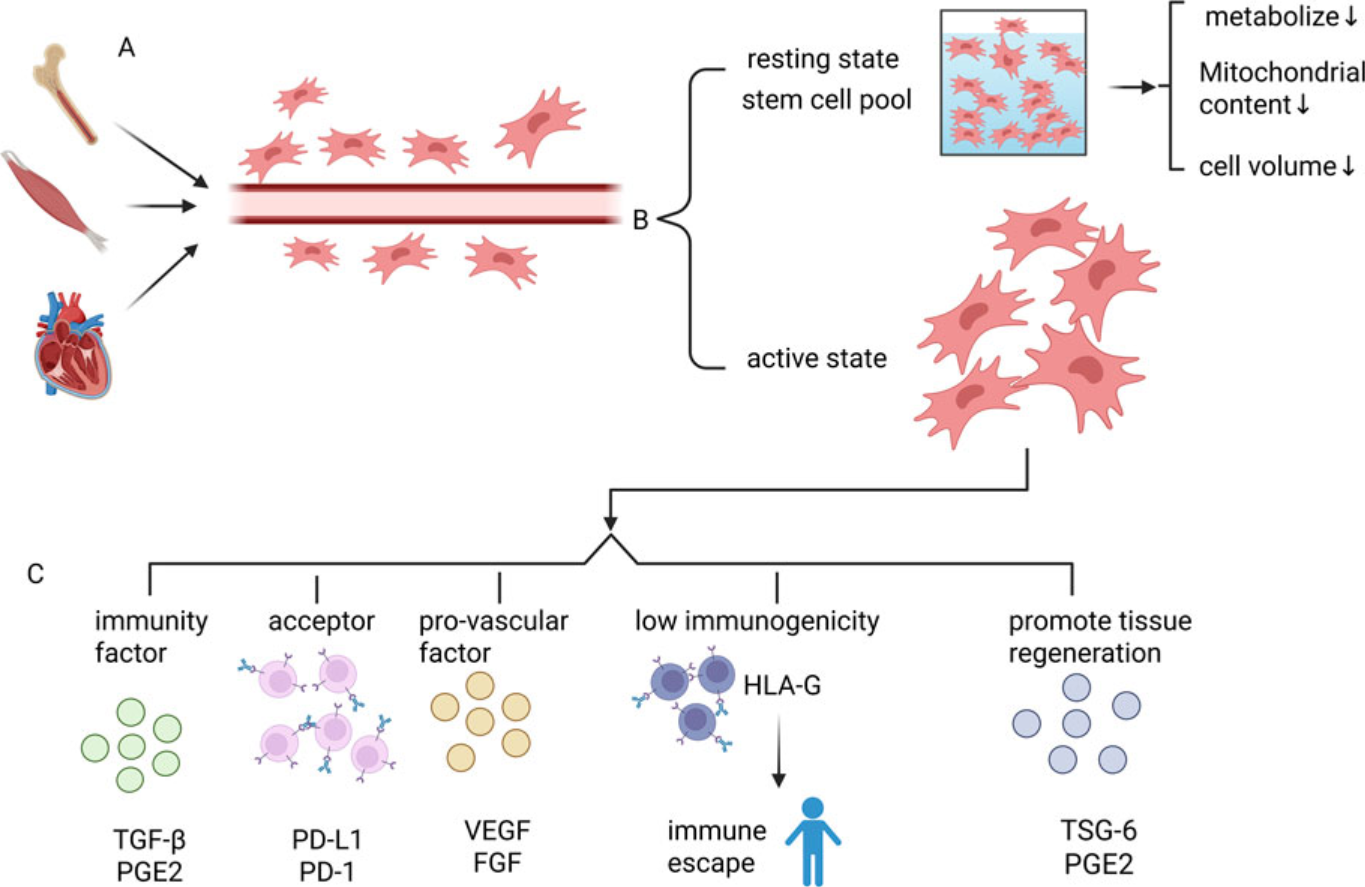
间充质干细胞是一类源自中胚层的成体干细胞,具有多向分化潜能,广泛分布于骨髓、脂肪、脐带等组织中,并常富集于血管周围。这类细胞在组织修复领域备受关注,主要得益于其以下三方面能力:
1.多向分化潜能
MSCs具备分化为多种细胞类型的能力。例如,在骨骼修复过程中,它可分化为成骨细胞;在肌肉修复时,能通过调控相关信号通路,避免分化为脂肪细胞,进而促进肌肉组织再生。
2.免疫调节功能
MSCs可通过分泌转化生长因子 -β(TGF -β)、前列腺素 E2(PGE2)等因子调节免疫反应,还能借助细胞膜表面的程序性死亡受体配体 1(PD - L1)等分子与免疫细胞相互作用,抑制异常免疫攻击。此外,MSCs免疫原性较低,移植后不易引发宿主免疫排斥反应。
3.旁分泌作用
MSCs可释放多种生长因子,如胰岛素样生长因子 -1(IGF - 1)、血管内皮生长因子(VEGF)等,激活体内的修复机制。以肌肉受损为例,其分泌的 IGF - 1 能促进肌肉卫星细胞的增殖与分化,从而参与肌纤维的再生。
MSCs在骨骼肌修复中的作用
骨骼肌是人体重要的代谢器官,不仅承担运动功能,还参与调节机体的代谢过程。多种因素,如运动损伤、衰老或代谢性疾病等,都可能导致骨骼肌的结构与功能受损。而 MSCs 在骨骼肌修复过程中发挥着多方面作用:
1.定向迁移与定位
肌肉组织受损后会释放基质细胞衍生因子 -1(SDF - 1)等趋化因子,MSCs 通过其表面的趋化因子受体 4(CXCR4)识别这些信号,并迁移至损伤部位参与修复。

2.改善代谢环境
在肥胖等代谢异常状态下,MSCs 可通过 WNT5a/糖原合成酶激酶 -3(GSK3)等信号通路抑制脂肪生成相关蛋白(如过氧化物酶体增殖物激活受体γ,PPARγ)的表达,同时促进肌肉保护因子的产生,从而减少肌内脂肪沉积,改善肌肉功能。
3.抗衰老效应
随着年龄增长,内源性 MSCs 的功能逐渐衰退。研究表明,补充年轻 MSCs 或其外泌体,可提高 WNT1 诱导信号蛋白 1(WISP1)等因子的分泌水平,激活蛋白激酶 B/哺乳动物雷帕霉素靶蛋白(Akt/mTOR)等修复通路,延缓肌肉萎缩进程。

MSCs在重症肌无力中的应用潜力
重症肌无力(MG)是一种由自身免疫反应引发的神经肌肉疾病,其特征为肌肉无力,症状常随时间或活动加重。发病机制主要与抗乙酰胆碱受体抗体攻击神经肌肉接头有关。MSCs 通过以下机制在MG中发挥作用:
1.免疫调节
MSCs 能够抑制异常活化的 T 细胞,促进调节性 T 细胞(Treg)的增殖,从而减少自身抗体的产生。此外,其分泌的吲哚胺 2,3 - 双加氧酶(IDO)、白细胞介素 - 10(IL - 10)等因子有助于减轻局部炎症反应。
2.神经肌肉接头保护
MSCs 可分泌胶质细胞源性神经营养因子(GDNF)、脑源性神经营养因子(BDNF)等多种神经营养因子,促进神经轴突再生与神经肌肉接头的修复。同时,通过上调胆碱乙酰转移酶(ChAT)、囊泡乙酰胆碱转运体(VAChT)等蛋白的表达,增强乙酰胆碱的合成与释放,改善神经信号传导。
动物实验显示,移植 MSCs 能显著降低模型小鼠的抗体水平,恢复免疫平衡,并提升肌力。在人源化小鼠模型中,MSCs 联合免疫细胞应用可在较短时间内显著缓解病情。
结语
长春中医药大学团队的这篇综述系统阐释了 MSCs 在骨骼肌修复与重症肌无力干预中的多重作用,同时指出了当前临床转化中的难点及可能的解决路径。相较于传统的免疫抑制疗法,MSCs 在调节免疫和促进组织修复方面具有独特优势。
随着相关技术的不断进步,MSCs 有望成为神经肌肉疾病应用领域的重要选择,为患者带来新的希望。