自20世纪起,诺贝尔基金会就有规定不能将诺贝尔奖颁给已经过世的科学工作者。而世界总是充满了偶然和巧合,2011年的奖项授予拉尔夫·斯坦曼(Ralph Steinman)后,人们发现这位刚刚获此殊荣的科学家,已在三天前与世长辞。
不过诺贝尔基金会经过紧急磋商后宣布,尽管斯坦曼教授在奖项公布前不幸离世,但评奖委员会在做出决定时并不知情,其获奖资格依然有效。
这份奖项,不仅表彰了拉尔夫·斯坦曼在1973年那个历史性发现,也无形中涵盖了他直至生命最后一刻,以非凡勇气和科学热忱所完成的、那场悲壮的自身临床试验。

据拉尔夫·斯坦曼在2010年的一场讲座里叙述,故事始于1970年。那时,他加入了赞维尔·科恩(Zanvil A. Cohn)领导的洛克菲勒大学实验室。
在医学培训期间,他被一解释了免疫系统如何影响众多医学领域,每个领域都有其独特复杂的理论打动。该理论后来也被证实,指出该系统包含大量淋巴细胞,数万亿个细胞。每个细胞都有单一特异性的抗原受体,但在这些细胞库中,有少数细胞专门针对与每种疾病相关的蛋白质或其他抗原。在感染期间,例如流感,会选择特异性于单个病毒蛋白的稀有细胞进行扩增,形成数百万或更多流感特异性保护细胞的克隆。
偶然的发现:显微镜下的“树突”
在他第二年博士后期间,他探索了脾脏。当时脾脏细胞悬浮液被用于启动免疫,即抗原特异性克隆选择,这些方法被称为米谢尔·达顿培养。令人惊讶的是,除了淋巴细胞和抗原外,还需要添加辅助细胞。
在检查这些异质辅助细胞时,发现了完全意想不到的情况。该群体中含有的细胞看起来与既往见过的任何巨噬细胞都不同。经过培养,它们不断形成和收缩突起或树突,于是称这些特殊的细胞为树突状细胞(DC)。

揭秘树突状细胞,免疫系统的核心指挥官
自DC早期发现以来,斯坦曼团队又做出了更多发现,为DC功能提供了更深入的见解。在1973年至1978年间发表的研究中,他证明这些细胞在形式和功能上都与已知免疫细胞不同,并且是免疫的专门化启动者。
他们找到了一条解释机体对特定蛋白及移植抗原产生免疫启动的路径。进一步证明树突状细胞是免疫系统的哨兵。他们巡逻尸体,不断观察周围环境,防范潜在危险。当DC遇到可疑抗原时,它们会捕获、处理,然后将其送达给B细胞和T细胞,使它们能够对体内携带该抗原的任何细胞进行精确攻击。
得益于斯坦曼博士及其他研究者数十年的努力,现已知DC是免疫极其强大的启动者,其激活免疫反应的能力是免疫库中任何其他细胞的100倍。凭借这一独特能力,DC现已成为全球实验室和临床研究的主要焦点,是癌症疫苗开发中的关键目标。
斯坦曼表示:不同的临床状况会有不同的免疫反应。无论是过敏原、病毒还是肿瘤,DC都能成为中介,教导免疫系统该怎么做。DC细胞还参与产生免疫记忆和诱导耐受,即免疫反应被沉默以防止危险的自身免疫。
以身为试验:与“癌王”赛跑的四年半
十分戏剧性的是,斯坦曼教授最终罹患胰腺癌。这种一种以恶性程度高、预后极差著称的癌症,被成为“癌王”。而这位科学家居然将自己投入了一场基于DC细胞的临床试验。他基于自己毕生发现并研究的树突状细胞(DC),为自己设计并实施了实验性的治疗性DC疫苗。令人震惊的是,他的病情得到了显著控制——原本预期仅剩几个月的生命,最终延长了四年半。遗憾的是,斯坦曼终究还是因病情恶化去世,距离诺贝尔奖公布仅差三天。
如今,DC细胞已经成为癌症疫苗设计的重点之一,旨在训练身体免疫系统攻击癌症。2010年,美国食品药品监督管理局(FDA)批准一款DC细胞疫苗Provenge®用于治疗晚期前列腺癌,目前,国内外正在开发针对乳腺癌、肺癌、肾癌、肝癌、胰腺癌的DC细胞相关治疗性癌症疫苗,并取得了一定的效果。
新抗原DC疫苗,为胰腺癌患者带来长生存曙光
2025年4月3日,日本研究人员在《Frontiers in lmmunology》发表了一项新抗原DC疫苗(Neo-P DC疫苗)针对胰腺癌的研究。这项研究回顾性评估了胰腺癌手术治疗后新抗原肽脉冲树突状细胞(Neo-P DC)疫苗治疗的安全性和疗效。

结果显示,在接受Neo-P DC疫苗的16名患者中,有13人(81.3%)诱导了新抗原特异性T细胞。在对九例复发后接种Neo-P DC疫苗患者的生存分析中,新抗原特异性T细胞诱导患者的总体生存期比未诱导者更长,有3例复发后生存期超过36个月。值得注意的是,在接种Neo-P DC疫苗作为辅助环境中的七名患者中,只有一人出现复发,且无患者在术后61个月的中位随访期间死亡。该复发病例涉及单一肝转移病灶,通过射频消融消失。患者在射频消融治疗后50个月内未出现新的复发迹象。

在一例复发患者中,显示出新抗原反应性T细胞的诱导非常强。患者接受新辅助化疗(吉西他滨+S-1)后,接受了手术治疗,发现71个淋巴结中有6个转移。术后辅用S-1化疗后,主动脉旁淋巴结转移灶增大。
虽然后来改良了化疗方案进行全身化疗,但没有明显效果。于是在术后31个月起,患者在化疗的基础上接受了新生抗原树突状细胞(Neo-P DC)疫苗治疗。完成6次Neo-P DC疫苗接种后,CT显示转移灶显著缩小。并且结果可能表明长链新生抗原肽成功诱导了新生抗原特异性CD4+ T细胞,并促进了肿瘤消退。
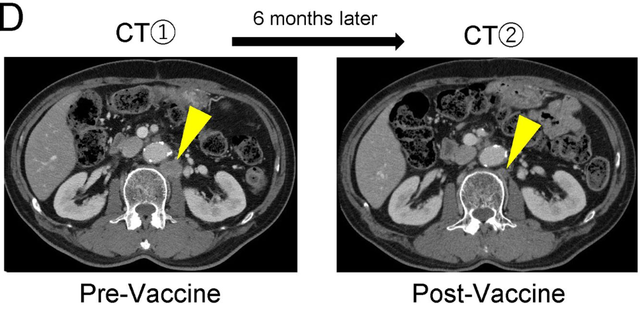
这项研究表明了Neo-P DC疫苗治疗在胰腺癌术后复发病例和辅助治疗中的可行性和疗效。
DC疫苗联合治疗显优势,显著提升乳腺癌病理缓解与长期生存
2021年12月,《Therapeutic Advances in Medical Oncology》发表了树突状细胞疫苗联合新辅助化疗(NAC)在HER2阴性乳腺癌患者中的安全性、可行性和有效性。

39例HER2阴性早期乳腺癌初治患者接受治疗,DC细胞疫苗联合新辅助化疗组病理完全缓解(tpCR)率为28.9%,而单独新辅助化疗组病理完全缓解(tpCR)率为9.1%。

长期生存数据更显优势:DC细胞疫苗联合新辅助化疗组5年生存率高达94.87%,7年生存率高达91.36%,单独新辅助化疗组5年和7年生存率分别为90.41%和87.58%。

这些数据表明,在标准新辅助化疗基础上加入DC疫苗治疗,可以显著提高HER2阴性乳腺癌患者的治疗效果。
综上可见,DC细胞疫苗是一种有前途的癌症治疗选择。
结语
拉尔夫·斯坦曼的生命,最终定格在了获奖喜讯传来之前。然而,他的科学遗产却通过那座迟来的诺贝尔奖章,获得了永恒的加冕。斯坦曼个人的赛跑虽然结束,但他亲手点燃的火炬,已由全球无数科学家和医生接过。这场由他奠基的免疫治疗革命,正以前所未有的广度和深度持续推进,为全球数百万癌症患者带来新的希望之光。而这一切,都始于五十年前,一位科学家在显微镜下,对那些拥有美丽树枝状突起的细胞所产生的好奇与执着。这或许就是科学最动人的模样:源于对人类生命奥秘最纯粹的探寻,最终化作对抗苦难最有力的武器。