肿瘤血管生成和免疫在癌症进展和预后中呈负相关。这篇文章报道了ZBTB46,一种抑制性转录因子和被广泛接受的经典树突状细胞(dendritic cells,DCs)的标记物,控制肿瘤血管生成和免疫。ZBTB46在树突状细胞和内皮细胞中均被肿瘤源性因子下调,从而促进肿瘤的强劲生长。ZBTB46下调导致标志性的促肿瘤微环境(microenvironment,TME)出现,包括血管功能障碍和免疫抑制。对人类癌症数据的分析显示,低ZBTB46表达与免疫抑制性TME和较差的预后存在类似的关联。相反,增强ZBTB46表达导致TME改变,从而限制肿瘤生长。从机制上讲,缺乏ZBTB46的内皮细胞是高度血管生成的,而缺乏ZBTB46的骨髓祖细胞上调Cebpb并将DC程序转向免疫抑制髓系输出,这可能解释癌症中的髓系扭曲现象。相反,强制表达ZBTB46使肿瘤血管正常化,并通过抑制Cebpb使骨髓前体向免疫刺激的髓系输出倾斜,导致免疫增强的TME。值得注意的是,在临床前模型中,ZBTB46 mRNA治疗与抗PD1免疫治疗协同改善肿瘤管理。这些发现确定ZBTB46是癌症中血管生成和骨髓谱系起作用的关键因素,维持其表达可能具有治疗益处。
抗击晚期癌症的“靶免联合”方案,也就是免疫检查点抑制剂与靶向药物的组合,而要说与免疫治疗战友情最紧密的搭档,当然是抗血管生成类药物,不管是大分子单抗还是小分子酪氨酸激酶抑制剂(TKI),它们都能通过抑制新生血管生成给肿瘤断粮,且主要针对的VEGF通路又同时介导着肿瘤微环境中的免疫抑制作用[1]。
所以说,靶免联合就由此实现了“一箭双雕”,但这么“优质”的治疗靶点还不止VEGF,今天在《自然·免疫学》期刊上,圣路易斯华盛顿大学(WUSTL)团队发表的研究成果就揭示,树突状细胞(DCs)特异性的转录因子ZBTB46,也可同时调控肿瘤新生血管生成和微环境免疫抑制性,但与VEGF不同的是,上调ZBTB46才能利好抗肿瘤免疫应答[2]!
研究者们发现,人体肿瘤内普遍存在ZBTB46的表达下调,而相应编码基因Zbtb46缺陷会使内皮细胞(ECs)的促血管生成能力大幅增强,如果Zbtb46缺陷发生在骨髓祖细胞身上,则会导致DCs的细胞程序发生“髓系偏移”(myeloid lineage skewing),转变为免疫抑制性髓系细胞,因此用mRNA治疗等方式恢复减少的ZBTB46,才能双管齐下助力免疫治疗。

论文首页截图
虽然学界早早就确认了ZBTB46作为经典DCs标志物的意义,但直到2019年才有研究认为它可能对血管生成有调控作用[3],而且由于研究并不是在肿瘤模型上进行的,还不能确认实体瘤中DCs的ZBTB46表达状况,以及肿瘤新生血管生成是否会受ZBTB46的影响。
所以本次研究一上来,WUSTL团队就尝试敲除了多种实体瘤模型小鼠体内的DCs,以及肿瘤相关ECs和骨髓内的Zbtb46表达,这随即带来了显著的促癌作用,肿瘤微环境中DCs的数量减少,细胞毒性T细胞/调节性T细胞比例下降,都说明ZBTB46本身有抑癌作用;同时,肿瘤新生血管生成也显著增多,这就主要与受到影响的ECs有关了。
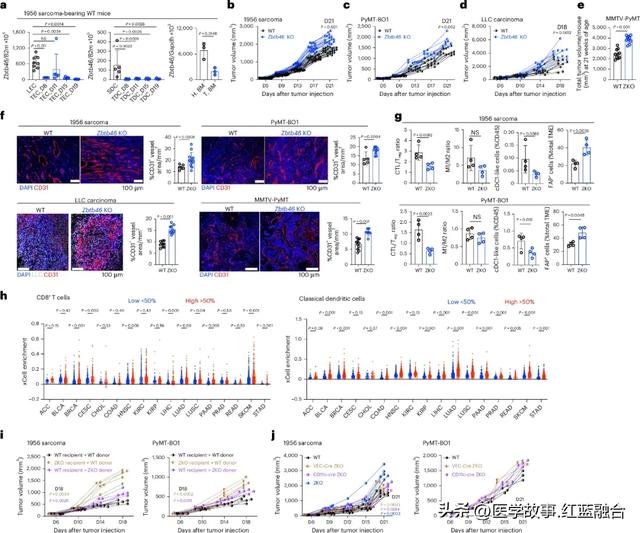
敲除Zbtb46的促癌作用,可以反证ZBTB46本身具有抑癌作用
接下来,研究者们以慢病毒载体传递的方式恢复了上述几种细胞的Zbtb46表达,抑癌作用也立竿见影,且实验也显示ZBTB46过表达不会直接影响癌细胞,但会让肿瘤血管明显正常化,使肿瘤组织灌注改善、乏氧状态被缓解,这对改善CD8+T细胞向肿瘤的浸润非常关键,也与靶向VEGF通路的抗血管生成类靶向药功效相似。

恢复肿瘤微环境Zbtb46表达的抑癌效应
不过,前面这一通对Zbtb46表达的操作,并未对DCs在抗肿瘤免疫中的经典功能产生影响,这也符合常规状态下对DCs特异性敲除Zbtb46的效果,然而DCs真就这么置身事外了吗?研究者们对比了普通小鼠与造血系统特异性敲除Zbtb46的小鼠,发现在同样植入肿瘤时,后者体内的髓系来源促癌组分,如髓系来源的免疫抑制细胞(MDSCs)显著增多。
进一步分析显示,敲除骨髓祖细胞的Zbtb46确实会减少它们产生的1型cDCs,而这些细胞的MHC-II类分子表达阳性,具有参与抗肿瘤免疫的能力;与此同时,源自骨髓祖细胞的Gr1+细胞则显著增多,它们往往就是肿瘤微环境中的MDSCs,因此ZBTB46其实是从源头有效减少了MDSCs;在骨髓祖细胞中调控上述过程的关键转录因子是C/EBPβ,正常存在的ZBTB46正是通过与其编码基因Cebpb启动子部位结合,下调其表达来发挥抑癌效应。
结合免疫细胞亚群和其它细胞组分的改变来看,ZBTB46对肿瘤微环境的调节效应非常广泛,主要包括:增加CD8+效应T细胞及CD4+T细胞(非调节性)、偏向抑癌的M1型肿瘤相关巨噬细胞(TAMs)、1型cDCs样髓系细胞、成熟和激活的NK细胞及成纤维细胞(促血管生成能力低),并减少M2型TAMs、促癌中性粒细胞、成纤维细胞和促血管生成性ECs。

ZBTB46可使肿瘤微环境整体更有利于免疫应答
可想而知,ZBTB46自然是癌细胞眼里的“死敌”,研究者们证实癌细胞可能通过产生活性氧(ROS)、前列腺素E2(PGE2)、维甲酸(RA)和VEGF等多种方式,下调DCs和ECs的ZBTB46表达,虽说针对这些途径的反制手段已经获批了不少,但实验中的收效都不明显,所以研究者们最终验证的方式是以纳米颗粒携带Zbtb46 mRNA,即使采用系统性给药的方式,它们也能集合到肿瘤微环境并发挥免疫调节作用,与PD-1抑制剂有效协同作战。

治疗性补充ZBTB46能够与PD-1抑制剂有效协同抑癌
参考文献:
[1]Fukumura D, Kloepper J, Amoozgar Z, et al. Enhancing cancer immunotherapy using antiangiogenics: opportunities and challenges[J]. Nature Reviews Clinical Oncology, 2018, 15(5): 325-340.
[2]Kabir A U, Zeng C, Subramanian M, et al. ZBTB46 coordinates angiogenesis and immunity to control tumor outcome[J]. Nature Immunology, 2024.
[3]Wang Y, Sun H Y, Kumar S, et al. ZBTB46 is a shear-sensitive transcription factor inhibiting endothelial cell proliferation via gene expression regulation of cell cycle proteins[J]. Laboratory Investigation, 2019, 99(3): 305-318.
